Более 40 лет уже ученые ведут активные поиски внеземной жизни. В их распоряжении мощнейшие радиотелескопы, периодически посылающие послания в различные области галактик, где предполагается существование разумных цивилизаций. Публике хорошо известен глобальный научный проект SETI по поиску сигналов иного разума. Миллионы долларов уже потрачено и еще много запланировано потратить. Только кажется, что эти деньги тратятся впустую. Если внеземной разум и существует, то ему гораздо легче найти нас, чем нам его. Вполне возможно, что земля уже входит в сферу его деятельности. Многие наверное помнят нашумевший когда-то фильм Дэникена “Воспоминания о будущем”. Публике были предъявлены, так сказать, вещественные доказательства пребывания на Земле в далеком прошлом представителей развитых инопланетных цивилизаций. Многие из этих вещдоков были сразу же опровергнуты, другие вызвали немало споров. Можно по разному трактовать рисунки инков и происхождение “взлетных полос” плоскогорья Наска. Для кого-то они выглядят убедительным подтверждением инопланетного присутствия, для других нет. Частые посещения Земли неопознанными летающими объектами также будоражат воображение многих ее обитателей. К тому же НЛО порой оставляют следы – правильные круги на полях, оплавленные породы с наведенной радиоактивностью и, как утверждается, искореженные в результате катастроф кусочки собственных конструкционных материалов. Итак, искомые “следы” вроде имеются. Но как к ним относиться? Много всякой чепухи здесь намешано. Каким образом можно отделить зерна от плевел? Ниже я попробовал сформулировать критерии, по которым можно судить о принадлежности тех или иных объектов к предметам искусственного внеземного происхождения:
- Уникальность – отсутствие аналогов в природе.
- Исключительная сложность – многократное превосходство в сложности перед другими природными объектами.
- Структурная упорядоченность, не являющаяся явным следствием действия известных физических сил – очевидная и уникальная упорядоченность элементов, из которых данный объект состоит.
- Архитектурная (геометрическая) правильность форм и симметричность.
- Высочайшая информативность – очевидное наличие какой-либо информации в объемах существенно превышающих таковую в природных объектах.
- Конкретность информации – узкая специфичность, содержательность информации и методов ее записи.
- Арифметические закономерности информационных последовательностей – применение неприродных математических правил записи информации.
- Высокотехнологичность – использование для изготовления предметов уникальных технологий, малодоступных или недоступных для человека.
- Необычная функциональность – выполнение объектом функций не свойственных окружающей среде и человеку.
Полагаю, что представленные критерии достаточно жесткие. Давайте попробуем оценить по ним объекты, претендующие на инопланетное происхождение. Пирамиды Хеопса тянут максимум на 6-7 баллов за счет своей явной искусственности. “Космодром” Наска – на 5, остатки загадочных материалов с места “катастрофы” НЛО в районе Дальнегорска – всего на 4. Не густо. Есть ли на Земле вообще объекты, удовлетворяющие всем 9 критериям? Да есть. Это белки и нуклеиновые кислоты, из которых состоят живые организмы. Разумеется, соответствие всем вышеописанным критериям не является доказательством их искусственного происхождения. Оно лишь подсказывает, в каком направлении следует искать. Давайте попробуем поискать другие свидетельства.
Итак, живые организмы состоят из тех же атомов, что и неживые, но совершенно других молекул. Кардинальное отличие – односторонняя симметрия структурных элементов белков и нуклеиновых кислот, огромная молекулярная масса биополимеров.
Что представляет собой белковая молекула? Ниточный полимер из разнородных нерегулярных звеньев – аминокислотных остатков. Аналогов подобному в природе нет. Удивительно, что эта нерегулярная аминокислотная последовательность соединяется исключительно регулярной пептидной связью – СO – NH – , все атомы которой лежат в одной плоскости. Образование пептидных цепочек аминокислот в водных растворах противоестественно (вопреки принципу Ле-Шателье), намного предпочтительнее возникновение водородных и дисульфидных связей между атомами боковых ветвей. Налицо неестественная и избирательная упорядоченность атомов в белковой молекуле. Метод формирования белков не имеет аналогов в природе. Углерод в органических соединениях образует 4 ковалентные связи и в соответствии с принципами кристаллографии, его полимер должен расти во всех четырех направлениях, формируя древовидные и сеточные структуры. Ни один кристалл не растет таким образом, чтобы подобно протеинам, сначала формировалась длиннющая нить толщиной до одного атома, а затем она складывалась, образуя плотное тело. Формирование белковой глобулы скорее напоминает вязание свитера, чем рост кристалла.
Обратимся к аминокислотному набору – базовым элементам белковой структуры. Обращает на себя внимание их дифференцированный выбор, предполагающий многоступенчатый отбор элементов из неограниченого исходного числа компонентов. Во-первых, это собственно аминокислоты, аминокислотный ряд, не включающий другие органические кислоты, нуклеотиды и прочее. Во-вторых, только 20 наименований из сотен возможных и существующих в природе. В-третьих, только α- модификации ( искючаются β, γ и другие изомеры). В-четвертых, только молекулы, имеющие пространственную L- ориентацию (D-ориентация абсолютно исключена). Каковы возможные механизмы подобного отбора? В природе наблюдается отбор по подобию (идентичности), совпадению химико-физических свойств, размерам и сходных условий формирования. Давайте проанализируем принципы отбора аминокислот стандартного ряда. Белковые аминокислоты легко поддаются классификации по структуре и свойствам их боковых цепей. Есть несколько методов классификации, наиболее показательным я считаю следующий. Аминокислотный набор распределяется на следующие группы: алифатическую (чисто углеводородная боковая цепь), содержащую 6 аминокислот, углеродзамещенную (боковая цепь содержит другие атомы, замещающие в ней углерод) – 10 аминокислот, и ароматическую – 4 аминокислоты. Первая пара алифатических аминокислот – самые простые – глицин и аланин, не имеющие собственных изомеров (аланин – ввиду L-ориентации). Следующий по сложности довольно простой гомолог, содержащий углеводородную цепочку из двух атомов углерода почему-то отсутствует, зато потом следует по два С5 и С6 изомера. Боковая цепочка одного из С5 изомеров замыкается на атом азота, образуя циклическую группировку (иминокислоту пролин). В углеродзамещенной группе четко прослеживается парность аминокислот: 2 серосодержащие аминокислоты, 2 – содержащие гидроксильную группировку OH, по паре аминокислот с выраженными кислотными и основными свойствами, 2 аминокислоты содержат амидные группировки. Принцип отбора – каждой твари по паре. Обращает на себя внимание большое разнообразие концевых группировок аминокислот, что обеспечивает богатое разнообразие свойств.
Оставшаяся небольшая ароматическая группа аминокислот не сохраняет принцип парности, зато остается принцип разнообразия: простое бензольное кольцо, затем добавляется основная азотсодержащая группировка, следующая аминокислота содержит бензольное кольцо с гидроксильной группой и наконец – двойное ароматическое кольцо. Это разнообразие еще более удивительно, если учесть явную ограниченность и консервативность химического состава самих аминокислот. Их состав можно выразить формулой 4 + 1, где 4 – количество обязательных атомов = числу атомов пептидного звена (- СO – NH -) + 1 дополнительный. Эта закономерность справедлива и для нуклеотидов – там дополнительным элементом является фосфор, а не сера, как у аминокислот. Характерно, что и число стандартных нуклеотидов также укладывается в эту формулу: исключительно по 4 – во всех нуклеиновых кислотах, но в РНК один из них (тимин) заменен урацилом. Поэтому, эту зависимость можно считать константой наряду с константами, выражающими число нуклеотидов в НК и аминокислот в белках. Все три константы связаны арифметически: 4 х (4+1) = 20.
На рис. 1 показано распределение аминокислот стандартного набора по числу содержащихся в них атомов углерода, равно как и суммы “больших” атомов (C, N, O, S).
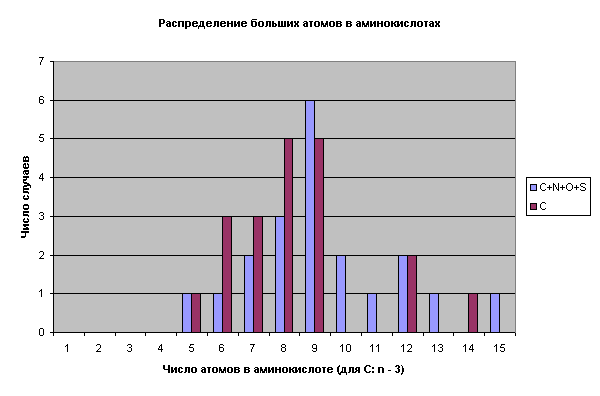
Хорошо заметно неравномерное распределение аминокислот по углероду, которое далеко от естественного. На первую половину диаграммы (3-6 атомов С) приходится 17 аминокислот и только 3 – на вторую (7-9 атомов С). Непонятен провал гомологического ряда между С6 и С9. Этот провал можно объяснить усиливающейся тенденцией к замене атомов углерода другими его аналогами. Это и обусловливает широкое разнообразие свойств боковых цепей аминокислот. Анализ аминокислот стандартного ряда показывает, что отмеченные ранее природные принципы отбора не могут объяснить их уникального разнообразия. Действительно, стандартные аминокислоты сильно различаются по строению, размерам, свойствам и сложности их образования. Реальным принципом отбора аминокислот является обеспечение максимально возможного разнообразия химических свойств концевых группировок боковых цепей. Парный характер подбора это разнообразие закрепляет, стабилизирует. Достаточно ли этого для утверждения искусственности белков и НК? Думаю, что нет. Поищем другие закономерности.
Перейдем теперь к связи генетического кода с аминокислотным составом белков. Известно, что любая аминокислота кодируется тремя нуклеотидами – кодоном. Каждому кодону соответствует только одна аминокислота или ни одной (стоп-кодоны). Но конкретной аминокислоте может соответствовать несколько кодонов, что называется вырожденностью генетического кода. Кодоно-аминокислотная взаимосвязь легко поддается систематизации. Весьма наглядна форма систематизации, изображенная на рис.2[1].
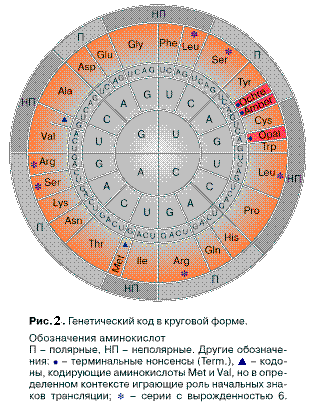
Нуклеотидная последовательность кодона читается от центра к периферии, где обозначена условными символами соответствующая ему аминокислота. Схема делится на 4 сектора, соответствующих начальной букве кодона. Каждый сектор в свою очередь – на 4 сегмента, соответствующих двухбуквенному началу кодона, а каждый сегмент – на 3 фрагмента – полное буквенное выражение каждого кодона. В схеме легко выделить начальный сектор G, включающий стартовый кодон GUG (GTG), первые аминокислоты гомологического ряда – глицин и аланин и конечный, содержащий стоп-кодоны и самые сложные аминокислоты – фенилаланин и триптофан. Многие исследователи усматривают в данной схеме определенные закономерности и симметрию (1, 2, 3, 4). Аминокислотам соответствуют отнюдь не случайные комбинации нуклеотидов. Определяющим звеном служат две первых буквы (x, y) кодона – его основа – и гораздо менее – третья. Основа называется сильной, если она полностью определяет смысл (аминокислоту) кодонов тетрады и слабой – если для однозначного кодирования аминокислоты необходимо также участие определенного третьего нуклеотида (z) в кодоне. Соответственно можно считать сильной аминокислоту, для кодирования которой используется сильная основа и наоборот.
На схеме хорошо заметна периодичность расположения кодонов, соответствующих полярным и неполярным аминокислотам. Если провести ось симметрии через центр круга перпендикулярно плоскости листа и повернуть круг на 180˚ в плоскости листа, то все сильные и слабые основы сохраняют свои позиции – совмещаются с одноименными. Если провести через центр плоскость симметрии, перпендикулярную плоскости листа и строкам текста, то при зеркальном отражении круга в этой плоскости все сильные основы меняются местами со слабыми и наоборот.
Следует отметить, что симметрия на рис.2 просматривается неявно и трудно судить об искусственности или естественности ее происхождения. Давайте попробуем поставить себя на место предполагаемого дизайнера и логически проследить целесообразный путь сортировки аминокислот в указанной схеме. Разуму свойственно упорядоченное распределение, определенная внутренняя логика действий.
Первое, что надо сделать, это распределить аминокислоты согласно частоты предполагаемого использования и отвести им пропорциональное число кодонов. Наблюдается ли такая закономерность? Да. Известно, что количество кодонов, приходящееся на конкретные аминокислоты хорошо коррелирует с их встречаемостью в белках. И вот здесь нас ждет первый сюрприз. Каждая аминокислота иммеет стандартную группу атомов, образующую пептидную связь с другими аминокислотами и боковую цепь. У одних аминокислот боковая цепь по массе больше стандартной, у других – наоборот. Обозначим атомную массу стандартной пептидной основы Mp, боковой цепи в белке – Ms, а число кодонов, соответствующее аминокислоте – n. Тогда для аминокислот, обладающих более массивной боковой группой атомов, чем стандартная ( их 13), получим:
∑[(Ms – Mp) n] = 700
Оговоримся, что для расчета использовались целочисленные значения атомных масс химических элементов. Такой подход вполне правомерен в связи с особенностями изотопного состава белков [3]. Для остальных 7 аминокислот с меньшей боковой цепью, чем стандартная, эта сумма соответственно составит
∑[(Ms – Mp) n] = – 700
То есть число кодонов аминокислот подобрано таким образом, чтобы обеспечить идеальный массовый баланс молекулы белка! Подобный баланс наблюдается и в отношении гидрофобности аминокислот, но он не так четко выражен в связи с определенной условностью единиц ее измерения.
Пойдем дальше. Итак, имеем 8 сильных аминокислот, способных занять целый сегмент. 6 из них гидрофильные (по шкале OHM, имеющей конкретный физический смысл) и 2 гидрофобные. 3 сильные кислоты имеют избыточные кодоны.
Этап 2. Напрашивается распределение в первую очередь сильных, наиболее значимых аминокислот. Давайте посмотрим на распределение 6-ти сильных гидрофильных аминокислот (помечены голубым цветом), не включая сюда их избыточные кодоны, а затем добавим к ним 2 гидрофобные (коричневый цвет). Что мы видим (рис. 3 и 4)?
[one_half]
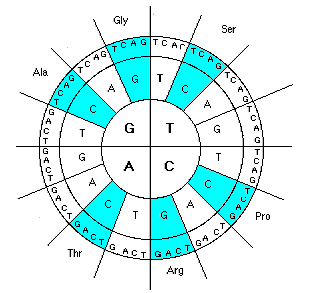
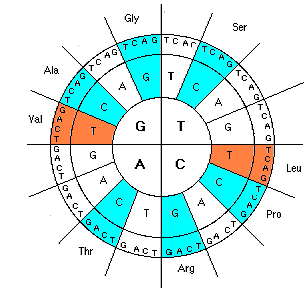
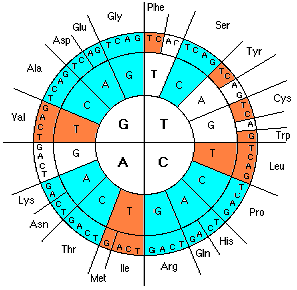
Каждая аминокислота состоит из стандартного пептидного звена и боковой цепи. Оказывается, что суммы атомных масс этих компонентов 8 сильных аминокислот, как и их общая масса (333, 592 и 925) без остатка делятся на простое число 37, причем результатом деления являются квадраты последовательного ряда чисел, которые в совокупности представляют собой не что иное, как теорему Пифагора (рис. 5). Суммы боковых цепей и пептидных звеньев остальной группы аминокислот равны (по 1110) и также делятся на 37 (рис. 5).
![Рис. 5 [В. Щербак].](https://lah.ru/wp-content/uploads/2006/10/image006.gif)
Этап 3. Очередной логический шаг – добавление в предыдущую схему (рис. 4) кодонов остальных 12 слабых аминокислот. Можно предвидеть нарушение симметрии. Посмотрим, что мы имеем в реальности (рис. 6).
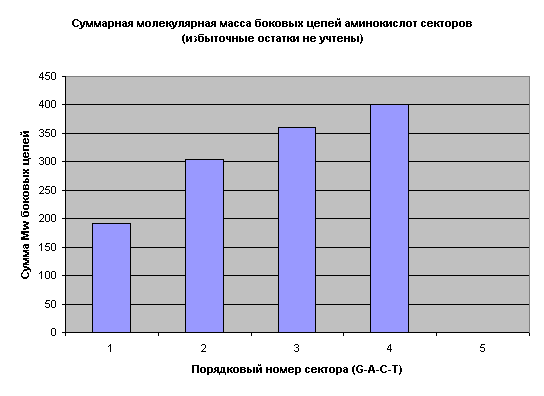
Взаимная симметрия нарушается только в двух секторах. Зато теперь выявляется новая закономерность – все аминокислоты оказались распределены по секторам строго равномерно: по 5 аминокислот в каждом секторе! Не напоминает ли это вам приведенную выше математическую зависимость между тремя константами генетического кода ( 4 х (4 + 1) = 20)? Но это еще не все. Равномерно распределенные по секторам аминокислоты показывают явную неравномерность, я бы сказал, закономерную неравномерность в их распределении по молекулярному весу (рис. 7).
Этап 4. Осталось добавить избыточные группы кодонов сильных аминокислот. Теперь схема приобретает свой законченный вид (рис. 8).
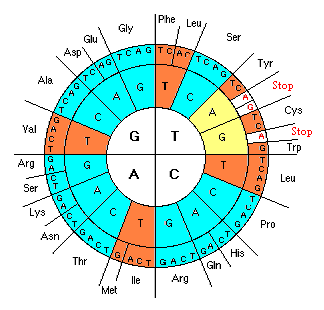
На рисунке желтым цветом закрашены сегменты с неопределенной гидрофобностью ввиду присутствия в них стоп-кодонов, не кодирующих аминокислоты. Что мы видим? Достигнутый уровень симметрии не нарушается. Зато теперь хорошо прослеживается периодичность расположения аминокислот по гидрофобности. И в эту периодическую последовательность вовлечены 14 сегментов из 16. Остальные два сектора – “мусорные” – в них включены неудобные аминокислоты (слишком большие по молекулярному весу тирозин и триптофан, а также самая реактивная – цистеин) и стоп-кодоны. Но это как раз то исключение, которое подтверждает правило. Наличие стоп-кодонов как бы сигнализирует нам о том, что главная последовательность здесь нарушена. Тем самым подчеркивается роль стоп-кодонов в терминации синтеза белка. На рис. 9 приведена диаграмма изменения гидрофобности аминокислот в порядке следования сегментов на схеме 8 (GG→GA→…TT).
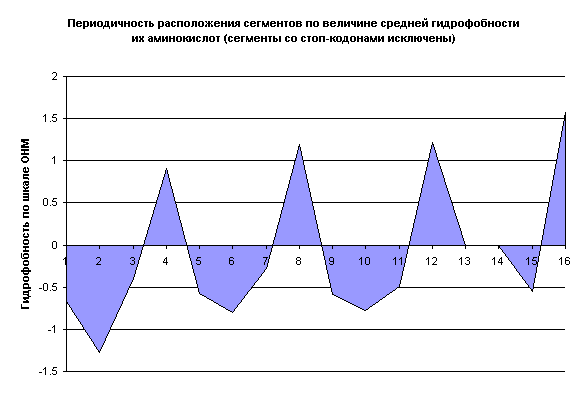
Как видим, периодичность распределения аминокислот по гидрофобности проявляется довольно наглядно. Характерно, что похожая периодичность наблюдается и в распределении аминокислот по молекулярному весу. Так что же это такое в действительности, периодическая система аминокислот? Но ведь 20 стандартных аминокислот – это просто нерегулярная выборка из бесконечной массы их возможных изомеров! В довершение ко всему появляется новая закономерность в распределении аминокислот по их относительной встречаемости в белках (рис. 10).
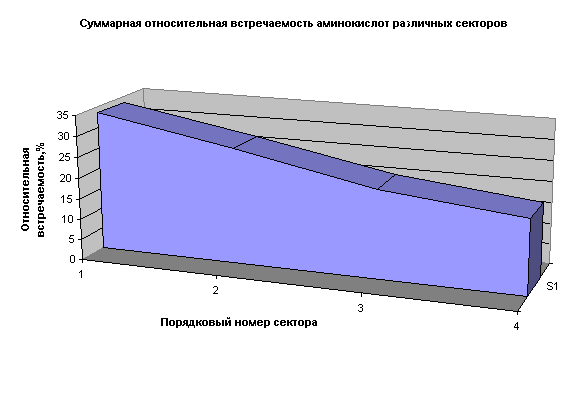
Вполне допускаю, что далеко не всем приведенные факты покажутся убедительными. Разумеется, приведенные закономерности еще ничего не доказывают. Но я считаю, что отмеченного достаточно, чтобы исследователи обратили пристальное внимание на эту проблему. Чем тратить миллионы на бесполезные поиски сигналов из бездны хаотических излучений космоса, лучше обратить внимание на реально существующий генетический код. Он ведь тоже может использоваться как способ передачи информации от одних поколений разумных существ другим.












Добавить комментарий